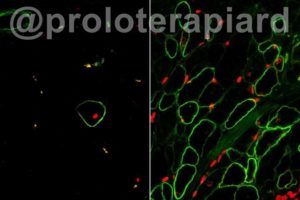
Células Músculo Esqueléticas aisladas usando los marcadores de superficie el ERBB3 y NGFR a la dereha) restaura la distrofina humana (verde) que después del transplante, aumentó significativamente más que los métodos anteriores (izquierda).
PUBLICACIÓN: 18-DEC-2017
El descubrimiento es un paso importante hacia una terapia de reemplazo de células madre para la distrofia muscular de Duchenne
UNIVERSIDAD DE CALIFORNIA – CIENCIAS DE LA SALUD DE LOS ÁNGELES
Los científicos de UCLA han desarrollado una nueva estrategia para aislar, madurar y trasplantar de forma eficiente las células del músculo esquelético creadas a partir de células madre pluripotentes humanas, que pueden producir todos los tipos de células del cuerpo. Los hallazgos son un paso importante hacia el desarrollo de una terapia de reemplazo de células madre para enfermedades musculares, incluida la Distrofia Muscular de Duchenne, que afecta aproximadamente a 1 de cada 5,000 niños en los EE. UU. Y es la enfermedad genética infantil más común.
El estudio fue publicado en la revista Nature Cell Biology por la autora principal April Pyle, profesora asociada de microbiología, inmunología y genética molecular y miembro de Eli y Edythe Broad Center de Medicina Regenerativa e Investigación de Células Madre en UCLA.
- 1. Restaurar la distrofina
Utilizando el proceso natural de desarrollo humano como guía, los investigadores desarrollaron formas de madurar las células musculares en el laboratorio para crear fibras musculares que restauran la distrofina, la proteína que falta en los músculos de los niños con Duchenne.
Sin distrofina, los músculos se degeneran y se vuelven progresivamente más débiles. Los síntomas de Duchenne generalmente comienzan en la infancia temprana; los pacientes pierden movilidad gradualmente y típicamente mueren por insuficiencia cardíaca o respiratoria alrededor de los 20 años. Actualmente no hay forma de revertir o curar la enfermedad.
Durante años, los científicos han estado probando diferentes métodos que dirigen las células madre pluripotentes humanas para generar células madre del músculo esquelético que puedan funcionar adecuadamente en los músculos vivos y regenerar las fibras musculares que producen distrofina. Sin embargo, el estudio dirigido por Pyle encontró que los métodos actuales son ineficientes; producen células inmaduras que no son apropiadas para modelar Duchenne en el laboratorio o crear una terapia de reemplazo celular para la enfermedad.
«Hemos encontrado que solo porque una célula del músculo esquelético producida en el laboratorio expresa marcadores musculares, no significa que sea completamente funcional», dijo Pyle. «Para que una terapia de células madre para Duchenne avance, debemos tener una mejor comprensión de las células que estamos generando a partir de células madre pluripotentes humanas en comparación con las células madre musculares que se encuentran naturalmente en el cuerpo humano y durante el proceso de desarrollo».
- 2. Descubrimiento de nuevos marcadores ERBB3 y NGFR
Al analizar el desarrollo humano, los investigadores encontraron una célula de músculo esquelético fetal que es extraordinariamente regenerativa. Tras un análisis adicional de estas células del músculo fetal, se descubrieron dos nuevos marcadores de superficie celular denominados ERBB3 y NGFR; esto permitió a los reservistas aislar precisamente las células musculares del tejido humano y separarlas de varios tipos de células creadas con células madre pluripotentes humanas.
Una vez que pudieron aislar las células del músculo esquelético utilizando los marcadores de superficie recién identificados, el equipo de investigación maduró esas células en el laboratorio para crear fibras musculares que producen distrofina. Las fibras musculares que crearon eran células musculares uniformes, pero las fibras eran aún más pequeñas que las que se encuentran en el músculo humano real.
«Nos faltaba otro componente clave», dijo Michael Hicks, autor principal del estudio. Las células del músculo esquelético no estaban madurando adecuadamente, explicó. «Necesitábamos músculos más grandes y fuertes que también tuvieran la capacidad de contraerse».
- 3. Inhibción de TGF B
Una vez más, el equipo buscó las respuestas en las etapas naturales del desarrollo humano. Hicks descubrió que una vía específica de señalización celular llamada TGF Beta debe desactivarse para permitir la generación de fibras musculares esqueléticas que contienen las proteínas que ayudan a los músculos a contraerse. Finalmente, el equipo probó su nuevo método en un modelo de ratón de Duchenne.
«Nuestro objetivo a largo plazo es desarrollar una terapia de reemplazo celular personalizada utilizando las propias células del paciente para tratar a los niños con Duchenne», dijo Hicks. «Entonces, para este estudio seguimos los mismos pasos, de principio a fin, que seguiríamos al crear estas células para un paciente humano».
Primero, las células del paciente con Duchenne se reprogramaron para convertirse en células madre pluripotentes. Luego, los investigadores eliminaron la mutación genética que causa Duchenne utilizando la tecnología de edición de genes CRISPR-Cas9. Usando los marcadores de superficie ERBB3 y NGFR, las células del músculo esquelético se aislaron y luego se inyectaron en ratones al mismo tiempo que se administraba un inhibidor de TGF Beta.
«Los resultados fueron exactamente lo que esperábamos», dijo Pyle. «Este es el primer estudio que demuestra que las células musculares funcionales se pueden crear en un laboratorio y restaurar la distrofina en modelos animales de Duchenne usando el proceso de desarrollo humano como guía. «La investigación adicional se centrará en generar células madre del músculo esquelético que puedan responder a lesiones continuas y regenerar nuevos músculos a largo plazo utilizando la nueva estrategia de aislamiento y maduración del equipo.







 Español
Español