por Alicia Filley. Diagnose and treat, Musculoskeletal injuries.
Los tendones son bandas de tejido conjuntivo resistente que conectan los músculos con los huesos. Conducen la fuerza generada por el músculo para mover el hueso; por lo tanto, deben ser lo suficientemente fuertes como para soportar la transmisión de fuerzas, pero lo suficientemente flexibles como para, en algunos casos, actuar como poleas alrededor de las prominencias óseas. El colágeno, una proteína que se encuentra en la matriz extracelular (MEC) del tejido conectivo, le da a los tendones su resistencia a la tracción y les permite estirarse sin romperse. Las moléculas de colágeno se unen para formar una microfibrilla, y las microfibrillas se unen para formar una fibra de colágeno. Muchas fibras de colágeno forman un haz de fibras y muchos haces de fibras unidos se llaman fascículos tendinosos.
Los haces de fibras y los fascículos tendinosos están envueltos en una delgada capa de tejido conjuntivo laxo llamado endotenón. El endotenón permite que los haces y los fascículos se muevan independientemente el uno del otro, deslizándose uno contra el otro según sea necesario para ajustarse al ángulo y la fuerza entre el músculo y el hueso. El endotenón es una continuación del tejido conectivo que rodea todo el tendón, llamado epitenón. Algunos tendones tienen una cubierta adicional tipo vaina llamada peratenon, que, aunque funciona con el tendón, es una estructura distinta.
El tenocito, la célula reguladora dentro del tendón, modula la secreción de la matriz extracelular y el ensamblaje del colágeno dentro del tendón. Los tenocitos se encuentran en largas filas a lo largo de las fibras de colágeno y también se encuentran en el endotenón y epitenón del tendón. Los tenocitos forman una red conectiva de proyecciones similares a dedos que permite que las células se comuniquen entre sí en cuanto a la necesidad de síntesis o degradación de las fibras de colágeno. Activan la formación de más células de colágeno cuando experimentan tensiones de corta duración. La tensión prolongada, sin embargo, da como resultado la inhibición del colágeno.
El suministro de sangre a los tendones es marcadamente menor que el del músculo al que están unidos. Los vasos que existen dentro del tendón son bastante pequeños y corren a lo largo de los fascículos dentro de la vaina del endotelón. Algunas áreas del tendón carecen por completo de un suministro de sangre. Como se podría sospechar, estas áreas son especialmente vulnerables a la degeneración y la ruptura.
Los tendones se componen de agrupamientos de bloques de construcción que comienzan con moléculas de colágeno que se unen para formar microfibrillas de colágeno, luego fibroblastos tendinosos, luego fibras, haces de fibras y fascículos. Los fascículos están rodeados por el endotenón y se agrupan para formar el tendón mismo.
Lesión del tendón.
Los atletas frecuentemente se lesionan los tendones debido a un uso excesivo o trauma. De los 32 millones de lesiones musculoesqueléticas documentadas en los Estados Unidos anualmente, el 45% de ellas son lesiones de tendones, ligamentos o cápsulas articulares. Los tendones más comúnmente lesionados por los atletas son los tendones del manguito de los rotadores del hombro, el tendón de Aquiles, el tendón rotuliano y el tendón extensor del codo.
Los factores que ejercen presión sobre el tendón y contribuyen a lesiones por uso excesivo incluyen:
- Dirección de halón anormal debido a desalineación del esqueleto;
- Diferencias en la longitud de las extremidades;
- Debilidad o desequilibrios musculares;
- Articulaciones hipermóviles;
- Músculos inflexibles;
- Errores de entrenamiento;
- Equipo y calzado defectuosos o mal ajustados.
Notoriamente difícil de tratar, históricamente se pensó que la lesión del tendón era una afección inflamatoria y, por lo tanto, se denominaba tendinitis. El tratamiento fue dirigido a reducir la inflamación a través de medicamentos y modalidades antiinflamatorias tradicionales, y no tuvo éxito en gran medida. Un estudio adicional reveló que las células inflamatorias agudas estaban ausentes a pesar de una interrupción en la formación de colágeno dentro de un tendón lesionado. Se anunció un nuevo término, tendinosis, para describir las lesiones degenerativas observadas en el tejido del tendón y la ausencia de inflamación. A pesar de la nueva nomenclatura y la adición de terapias para abordar la degeneración del tendón en lugar de la inflamación, el tratamiento exitoso de la disfunción del tendón, que llamaremos tendinopatía, ha sido difícil de alcanzar.
La inflamación juega un papel.
Los avances en histología permiten a los científicos observar de cerca el proceso de tendinopatía. Los estudios del tendón humano lesionado son difíciles porque, para cuando una persona busca ayuda médica, la lesión suele ser crónica. Por lo tanto, se estudian modelos animales para revelar cambios agudos en los tendones. Científicos de la Queen Mary University in London examinaron la respuesta de los tenocitos de los tendones de caballo a la carga cíclica. Los fascículos de 6 caballos se dividieron en grupos de tratamiento y control. Las muestras de tratamiento se sometieron a una tensión de carga repetida, mientras que los controles permanecieron sin carga.
24 horas después de un protocolo de carga cíclica, las células de colágeno dentro de los fascículos de los tendones tratados parecían redondeadas y desorganizadas, mientras que las células de control eran largas, delgadas y alineadas longitudinalmente a lo largo del fascículo.
Se encontraron marcadores inflamatorios en las muestras tratadas después de su ciclo de carga, mientras que las muestras de control exhibieron pocos o ningún marcador de inflamación.
Los investigadores concluyeron que las células tendinosas responden a altos niveles de estrés con una reacción inflamatoria, especialmente en el período agudo después de la lesión.
Estos hallazgos son consistentes con otros estudios en animales, que encuentran un aumento en los marcadores inflamatorios después de episodios de carga o daño del tendón, así como un aumento en el número y tamaño de los tenocitos. La proliferación de tenocitos se sabe que ocurre en presencia de inflamación; por lo tanto, esta reacción se ve como un artefacto de una cascada inflamatoria previa. Mientras que la degeneración se ve en la lesión crónica del tendón, la inflamación puede ser el instigador de esos cambios dentro del tendón durante el período agudo de la enfermedad del tendón.
Evidencia adicional.
El examen de ultrasonido de los tendones sintomáticos muestra un aumento en el flujo sanguíneo a los tendones. Los tendones sanos son característicamente deficientes en el suministro de sangre, por lo tanto, para lograr este aumento de la circulación, nuevos vasos sanguíneos se infiltran en el tendón. Esta neovascularización típicamente ocurre junto con un nervio acompañante al vaso sanguíneo. Se cree que la aparición de nuevos nervios dentro del tendón lesionado es la causa del dolor en la tendinopatía.
Se supone que la afluencia de flujo sanguíneo es evidencia de degeneración dentro del tendón y un intento de curación del tejido dañado. Sin embargo, tal neovascularización y neoinnervación probablemente no podrían ocurrir sin la presencia de mediadores inflamatorios en algún momento. Investigadores de la Cambridge University señalan que la apariencia del cuerpo del tendón de pacientes con tendinopatía, debido a sobrecarga o lesión, es indistinguible en la ecografía de aquellos pacientes con diagnósticos inflamatorios conocidos, como la artritis reumatoide3.
Influencias bioquímicas.
La Ciclooxygenase-2 (COX-2) es una enzima, que en presencia de ácido araquidónico estimula la producción de prostanoides y produce inflamación. Los estudios muestran que los niveles de prostanoides aumentan en los tendones de animales sometidos a carga repetida. En tendones sometidos a prostanoides inyectados, los cambios observados dentro del tendón son consistentes con tendinopatía. Por lo tanto, la presencia de mayores niveles de prostanoides en los tendones enfermos es evidencia de un proceso inflamatorio dentro del tendón.
La sustancia P es un péptido secretado por los nervios y las células inflamatorias. Se cree que la presencia de sustancia P en cantidades significativas en la tendinopatía crónica es el resultado de un proceso inflamatorio dentro del tendón. La sustancia P causa un aumento en la cantidad de tenocitos en un tendón. Por lo tanto, el aumento del número de tenocitos observados en un tendón lesionado puede ser el resultado de mediadores inflamatorios como la sustancia P. La sustancia P también aumenta la proporción de colágeno III a moléculas de colágeno I en la matriz extracelular (MEC). En un tendón sano, el colágeno I es el tipo predominante que se encuentra dentro de la MEC. Este cambio en la composición del colágeno en la MEC bien puede explicar la diferencia en la forma y el tamaño del colágeno y la desorganización simultánea observada en el estudio de Londres.
Teoría de la degradación.
Investigadores en Melbourne, Australia, desarrollaron un modelo de lesión tendinosa en varias etapas que abarca el pensamiento actual sobre la tendinosis. Cuando un tendón sano experimenta una mayor carga, responde aumentando su rigidez para manejar la mayor demanda de fuerza y aumentar la producción de células de colágeno. Los investigadores australianos proponen que esta respuesta celular proliferativa pero no inflamatoria a corto plazo es una tendinopatía reactiva. Su pensamiento es que el aumento en las células es un intento del tendón de aumentar el área de la sección transversal y, por lo tanto, manejar mejor la carga. Esta adaptación a corto plazo es reversible si la carga disminuye o el tendón tiene una oportunidad de descansar antes de que se aplique el siguiente esfuerzo. Un tendón saludable se adapta al estrés haciéndose más grande y por lo tanto más fuerte. Un tendón enfermo no se recupera del estrés y progresa a la etapa dos denominada tendón en mal estado, el tendón intenta curarse añadiendo más células al ECM, lo que aumenta la proteína producción de proteoglicanos y colágeno. Proponen que es el aumento en el número de proteoglicanos lo que cambia la composición y el aspecto del colágeno y le da al ECM una apariencia más desorganizada. Observan el aumento de la vascularización en esta etapa. Su posición es que, con la modificación de la carga aplicada al tendón, la composición de la MEC puede alterarse y la curación aún puede tener lugar en esta etapa.
La etapa final es la tendinopatía degenerativa. El sello distintivo de esta etapa es la muerte celular, con áreas del tendón completamente desprovistas de células sanas y una ECM llena de vasos, subproductos metabólicos y poco más. Esta etapa se considera irreversible. La tendinopatía degenerativa se encuentra como lesiones distintas dentro de un tendón. El tendón lesionado puede presentar diversas etapas de degeneración en todo el tendón.
Dos lados de la misma moneda.
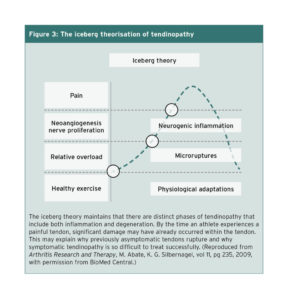
Lo que la histología revela sobre los tendones lesionados, de hecho, es que los cambios inflamatorios y los cambios degenerativos se encuentran dentro del mismo tendón. Un grupo de científicos de Italia y Suecia propuso un modelo diferente para la tendinopatía, que abarca tanto las observaciones inflamatorias y degenerativas. Conocida como la «teoría del iceberg», este modelo comienza con la suposición de que el ejercicio normal estimula la producción de colágeno nuevo dentro de un tendón. Al mismo tiempo, la degradación del colágeno también ocurre, probablemente como un medio de remodelación del tendón para acomodar la nueva carga. Por lo tanto, el ejercicio estimula la producción de marcadores inflamatorios y sustancias de crecimiento, ambos necesarios para la estimulación de la respuesta del tendón sano de la proliferación y la degradación. En los tendones sanos, la síntesis de colágeno gana en esta ecuación y el tendón se hace más grande y más fuerte.
Se necesita cesación de la carga, el descanso y el suministro adecuado de sangre para que el tendón se cure de la tensión excesiva. Si el tendón no tiene el suministro de sangre requerido, se producen factores que estimulan la angiogénesis. Se cree que la aparición de nuevos vasos, que generalmente incluyen nervios junto a los vasos sanguíneos, debilita la estructura del tendón. La secreción tanto de glutamato como de sustancia P por los nervios que brotan contribuye a la inflamación neurogénica y a la muerte de las células del tendón. Es en este punto del continuo que los atletas pueden quejarse de dolor y buscar atención médica.







 Español
Español