Las Células Madre pueden ayudar a la ceguera y a revertir el envejecimiento
Por JACQUELINE HOWARD, CNN, Marzo 9, 2018.
Apenas unos meses después de que la Administración de Drogas y Alimentos de los E.U., (FDA), anunciara los esfuerzos para acabar con las clínicas de Células Madre que promocionaban terapias no aprobadas, la agencia ahora planea ayudar a acelerar el desarrollo de terapias con Células Madre que sean seguras y efectivas.
El Dr. Scott Gottlieb, comisionado de la FDA, y el Dr. Peter Marks, director del FDA’s Center for Biologics Evaluation and Research, son coautores de un nuevo documento que detalla el delicado equilibrio entre seguridad e innovación cuando se trata de las posibilidades de usar Células Madre En medicina.
«Nuestro objetivo es remodelar nuestras herramientas tradicionales de regulación para cumplir con los desafíos y oportunidades presentados por productos tan innovadores como la Medicina Regenerativa basada en células», escribieron en el documento, publicado el jueves 8 de Marzo del 2018, en el New England Journal of Medicine.
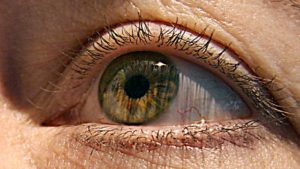
Las Células Madre tienen el potencial de convertirse en muchos tipos de células en el cuerpo. Algunos estudios sugieren que las Células Madre pueden ayudar a quienes están casi ciegos a recuperar la visión y que además pueden revertir los signos del envejecimiento. La investigación incluso ha explorado el uso de Células Madre para crear glóbulos rojos como propuesta para reponer la escasez de sangre durante las emergencias.
«Sin embargo, a pesar del uso cada vez más extendido de las Células Madre en las técnicas que se etiquetan como Medicina Regenerativa, el beneficio clínico no se ha demostrado claramente en la mayoría de los casos», escribieron Gottlieb y Marks.
La FDA espera cambiar eso, mientras continúa los esfuerzos para regular la industria.
«Esto refleja más una actualización de la FDA sobre dónde está su pensamiento sobre las Células Madre. No lo veo como un retroceso de la esperada intensificación de la supervisión de la FDA de las clínicas», dijo Paul Knoepfler, profesor de biología celular y anatomía humana en la California University, Davis School of Medicine, que escribió una publicación en el blog sobre el nuevo documento.
«La FDA parece estar diciendo que quieren encontrar un lugar ideal para la supervisión de Células Madre donde fomentan la innovación de buenos ciudadanos y también regulan cuidadosamente esta esfera, así como alentar a los interesados en trasplantar Células Madre a los pacientes para que trabajen con la FDA. » él dijo.
Knoepfler fue coautor de un artículo, publicado en la revista Stem Cell en 2016, que encontró intervenciones de Células Madre no aprobadas que se comercializaron en 570 clínicas en todo Estados Unidos. Las ciudades de «puntos calientes» donde hubo clusters de clínicas incluyeron Beverly Hills, California; Nueva York; San Antonio; Los Angeles; Austin, Texas; Scottsdale, Arizona y Phoenix.
Aunque Gottlieb y Marks no mencionaron las clínicas en su artículo, señalaron que: “facilitar la disponibilidad de terapias seguras y efectivas era parte de la supervisión de la FDA de los productos de Medicina Regenerativa, incluidas las nuevas terapias con Células Madre”.
La FDA proporcionará herramientas para alentar a grupos de médicos (individuales o pequeños), a colaborar en apoyo del desarrollo de Células Madres u otro producto de Medicina Regenerativa, escribieron.
Gottlieb y Marks también dijeron que la FDA está alentando a los investigadores que están involucrados en el desarrollo de productos innovadores para que entablen un diálogo con la agencia desde el principio del proceso de investigación.
«Parece que el liderazgo de la FDA es, en esencia, les está diciendo: ‘hagan lo correcto, y lo ayudaremos con una prueba, incluso si usted no es una gran universidad o compañía'», dijo Knoepfler. «Es alentador ver que la FDA aún enfatiza que es crucial tener datos y seguir las reglas».
La FDA realizó una transmisión por Internet de Grand Rounds el jueves que detalla cómo sus científicos están examinando estrategias y métodos para predecir la confiabilidad de cómo ciertas terapias basadas en células funcionarán en humanos.
La capacidad de hacer tales predicciones podría ser un gran paso hacia la obtención de tratamientos seguros y efectivos aprobados por la FDA para los pacientes, en el futuro.
Prediciendo el futuro
Para muchos productos en investigación, basados en Células Madre, aún no está claro si las medidas utilizadas actualmente para caracterizar los productos, predecirán su eficacia clínica, según la FDA.
Hasta el momento, los productos basados en Células Madre sometidos a la FDA en propuestas de ensayos clínicos que se caracterizan utilizando una pequeña cantidad de marcadores de superficie celular y medidas simples de actividad del producto celular, pero ¿es eso suficiente para predecir realmente los resultados clínicos?
Responder a esa pregunta se ha convertido en uno de los muchos enfoques del FDA’s Multipotent Stromal Cell Consortium, un gran equipo de científicos que estudian células estromales multipotentes adultas. Estas son Células Madre que pueden diferenciarse en una variedad de tipos de células y podrían contribuir a la reparación de tejidos o ayudar a reemplazar, restaurar o regenerar otras partes del cuerpo.
Steven Bauer, jefe de the cellular and tissues therapy branch in the Center for Biologics Evaluation and Research, pronunció la presentación principal en Grand Rounds del jueves y se centró en cómo, le predicción es la clave importante, en los casos en que las células estromales multipotentes se estudian para su uso como terapias.
«Podemos utilizar parte de esta información para ayudar a generar estándares en este campo», dijo. «Ahora hay un enorme interés en desarrollar estándares que faciliten el desarrollo de productos y medicamentos regenerativos».
En general, «en conjunto con la publicación del New England Journal of Medicine, la FDA quiere asegurarse de que los desarrolladores de Medicina Regenerativa comprendan las vías regulatorias que están disponibles.
«La FDA se ha comprometido a garantizar que los pacientes tengan acceso a productos de Medicina Regenerativa seguros y efectivos de la manera más eficiente posible», dijo la agencia en una declaración escrita enviada por correo electrónico a CNN por un vocero de la FDA. También estamos comprometidos con asegurarnos de tomar medidas contra los productos que se comercializan ilegalmente y que representan un riesgo potencial significativo para la seguridad». »
La agencia ha adoptado un enfoque basado en el riesgo y basado en la ciencia que se basa en las regulaciones existentes para apoyar el desarrollo de productos innovadores, al tiempo que las autoridades de la FDA y las prioridades de cumplimiento se aclaran. Este enfoque, basado en el riesgo, permite a los desarrolladores de productos, el tiempo necesario para poder interactuar con la FDA, determinar si necesitan enviar una solicitud de autorización de comercialización y, de ser así, enviar su solicitud a la FDA para su aprobación «, dijo el comunicado.







 Español
Español