Por Aliyah Kovner 10 ENE 2018
Las células musculares humanas funcionales se han cultivado en el laboratorio por primera vez, lo que supone un gran avance en la investigación sobre medicina regenerativa para lesiones y enfermedades extrañas que causan pérdida de masa muscular.
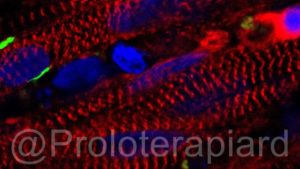
Un equipo de la Duke University utilizó Células Madre colocadas en un cultivo tridimensional para crear pequeños grupos de fibras musculares que se contraen y reaccionan ante estímulos eléctricos o químicos, al igual que el tejido muscular nativo.
El cultivo se inició con Células Madre pluripotentes inducidas (IPSC), un tipo de Célula Madre que se puede obtener de la sangre o la piel de un donante adulto. Las células maduras se exponen luego a ciertas proteínas, lo que las hace revertir a un estado primordial e indiferenciado.
En 2015, el mismo equipo generó tejido muscular utilizando células musculares existentes, llamadas mioblastos, tomadas de los pacientes. Desafortunadamente, este tipo de célula parental no se puede reproducir en grandes cantidades antes de que comiencen a descomponerse, lo que limita el tamaño del cultivo.
En el estudio actual, publicado en Nature Communications, al comenzar con IPSC el proceso fue significativamente más fructífero. Después de exponer las células a una molécula llamada Pax7, las IPSC comenzaron el proceso de desarrollo en el tejido muscular.
«Comenzar con Células Madre pluripotentes que no son células musculares, pero pueden convertirse en todas las células existentes en nuestro cuerpo, nos permite hacer crecer un número ilimitado de células progenitoras miogénicas», dijo el autor del estudio Nenad Bursac, profesor de ingeniería biomédica, en un comunicado. «Estas células progenitoras se asemejan a las Células Madre musculares adultas llamadas ‘células satélite’ que teóricamente pueden desarrollar un músculo entero a partir de una sola célula».
Este enfoque tiene el beneficio adicional de no descansar confiar en los tejidos donados, como las biopsias musculares. Este proceso puede ser doloroso e invasivo, y los pacientes con afecciones degenerativas heredadas ya experimentan síntomas horribles y deterioro físico.
«Cuando los músculos de un niño ya se están deshilachando como en la distrofia muscular de Duchenne, no sería ético tomar muestras de músculo de ellos y hacer más daño», continuó Bursac. «Pero con esta técnica, podemos tomar una pequeña muestra del tejido no muscular, como la piel o la sangre, revierte las células obtenidas a un estado pluripotente y eventualmente crece una cantidad interminable de fibras musculares funcionales para evaluar «.
Los haces de células resultantes pueden sobrevivir durante al menos un mes en un entorno de cultivo y muestran la promesa de la implantación en un cuerpo vivo. Pequeños grupos de fibras implantadas en ratones mantuvieron su capacidad de responder al estímulo y comenzaron a integrarse en el tejido circundante mediante el crecimiento de vasos sanguíneos, sobreviviendo durante al menos tres semanas.
Sin embargo, esta tecnología todavía está limitada por la escala y no podrá reemplazar los músculos completos en corto tiempo. En cambio, los autores esperan que el siguiente paso sea una combinación de reemplazo específico en parches pequeños y tratamientos sistémicos como la terapia génica.







 Español
Español